当PROTAC遇到环状mRNA:胞内不可成药靶点的新突破
环状mRNA编码PROTAC(RiboPROTAC)作为细胞内治疗靶标降解的新平台
<摘要预览>
作为一种正在崛起的新兴技术,PROTAC技术利用泛素-蛋白酶体系统人为地将胞内靶蛋白降解,具有降解很多所谓的“不可成药”靶点的巨大潜力,但是其仍然面临很多挑战,如筛选与目的蛋白结合分子难度高、只有少量的E3连接酶适合用于PROTAC分子开发等。基于蛋白的bioPROTAC特异性高,但是其细胞膜渗透性差,使得其应用范围受到极大限制。因此,我们开发了一种全新的靶蛋白降解平台,利用环状mRNA(cmRNA)编码bioPROTAC分子降解靶蛋白,并将其命名为RiboPROTAC。通过这种技术,模式蛋白GFP和细胞内源性蛋白PCNA被成功地降解。PCNA蛋白被大量降解后,肿瘤细胞的功能如细胞增殖、细胞凋亡和细胞周期随之受到了影响。而且,我们第一次发现了PCNA降解后引起了一定程度的细胞免疫原性死亡,其免疫原性在体内实验得到了验证。cmRNA编码PCNA降解剂在体内也展现出显著的抗肿瘤药效,这是第一个RiboPROTAC作为mRNA治疗药物的概念验证。 我们认为,RiboPROTAC将成为靶向不可成药靶点的一种新的强有力的技术。
PROTAC
(Proteolysis Targeting Chimeras,蛋白降解靶向嵌合体)
经过20年的不断完善和发展,目前成为新药研发领域最火热的技术之一。传统小分子和抗体等是通过“occupancy-driven”作用机制发挥抑制靶蛋白的功能, 该作用模式需要精准靶向靶蛋白的活性位点和较高的药物浓度。而PROTAC是通过“event-driven”直接将靶蛋白降解, 无需靶向活性位点,因此大大提高了靶点的选择范围, 使得很多“臭名昭著”的不可成药靶点重新获得新一轮研发热潮。
传统的基于化合物的PROTAC的研发仍然面临一些挑战,如与靶蛋白结合的分子筛选复杂、可供选择的E3 ligase配体较少、分子量大从而影响其细胞渗透性等。而基于蛋白质的bioPRTAC 拥有与靶蛋白的结合特异性高、可以任意选择需要的E3 ligase等特点, 但是它的递送难题极大影响了它在药物研发里的应用。
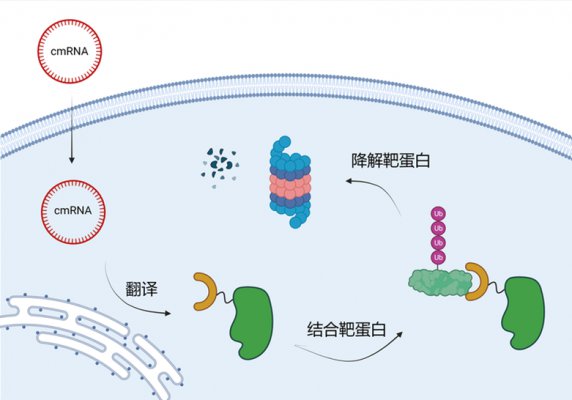
苏州科锐迈德生物医药科技有限公司基于环状mRNA平台开发了RiboPROTAC技术, 原理是利用环状mRNA编码蛋白降解靶向嵌合体,从而降解靶蛋白。与小分子PROTAC相比, RiboPROTAC具有研发速度快、与靶蛋白结合特异性高、自主表达E3 ligase可以不受宿主细胞E3 ligase 丰度及突变的影响; 与基于蛋白的bioPROTAC相比,RiboPROTAC具有可以实现全身或局部的递送、胞内存留时间更长、制备工艺更简单等优势。相信基于RiboPROTAC平台,更多不可成药靶点将变得druggable。相关文章近日发表在bioRvix上。
ABOUT US
关于科锐迈德CureMed
苏州科锐迈德(CureMed)是一家生物制药公司,专注于新一代环状mRNA核酸药物研发。公司已经申请30余项mRNA领域核心平台技术发明专利,多项PCT国际专利,2项软件著作权。目前已建立了环状mRNA技术平台,自主研发的新成环框架cleanPIE系统,无需引入外源序列,更低的免疫原性,更高的成环和表达效率。开发了自主知识产权LNP递送系统,核心专利已获得授权,实现了LNP核酸药物的量产。CureMed旨在打造综合性的环状mRNA核酸制药平台,积极布局感染性疾病、肿瘤免疫、蛋白替代、基因治疗、细胞疗法等产品管线,以满足临床巨大的治疗需要。
-
2022-10-10
科研速递 科锐迈德在Molecular…
研究背景新冠肆虐期间,BioNTech和Moderna两家公
-
2022-09-29
科锐迈德出席博鳌亚洲论坛2022国际科技
大会简介进入21世纪以来,全球科技创新空前密集活跃,新一轮科
-
2022-09-28
金斯瑞蓬勃生物亮相2022NID产业论坛
9月28日,NID 2022第二届核酸药物产业深度论坛在上海
-
2022-09-27
科锐迈德入选国家级核酸药物“揭榜挂帅”创
近日,国家生物药技术创新中心发布了2022年国家生物药技术创
-
2022-09-15
一项探索编码IL-12的环状mRNA(c
2022年9月15日下午,一项探索编码IL-12的环状mRN
