Clean PIE 成环框架

新冠疫情爆发以来,mRNA疫苗因为快速高效安全的大范围应用无疑成为生物医药皇冠上最耀眼的明珠。mRNA技术也走进公众视野,得到社会各层面的重视。进入后疫情时代,mRNA的应用领域不断被拓展,新的适应症需求体现了线性mRNA的各种不足。环状mRNA因为其无需加帽加尾的闭环结构,体内外更稳定,表达时间更长,制备工艺更简单,成本更优,有望成为线性mRNA的替代者,开启mRNA 2.0时代。
2022年6月21日,苏州科锐迈德生物医药科技有限公司(以下简称科锐迈德或CureMed)在预印版bioRxiv发表题为:Clean-PIE: a novel strategy for efficiently constructing precise circRNA with thoroughly minimized immunogenicity to direct potent and durable protein expression的研究论文1。

该研究公开了其高效、精准、低免疫原性的环状mRNA底层成环框架技术,称为“Clean-PIE”,实现了量产放大和体内长时间持续的表达。CureMed也继ORNA和Laronde之后,成为拥有底层自主知识产权和产业化能力的环状mRNA技术平台公司。
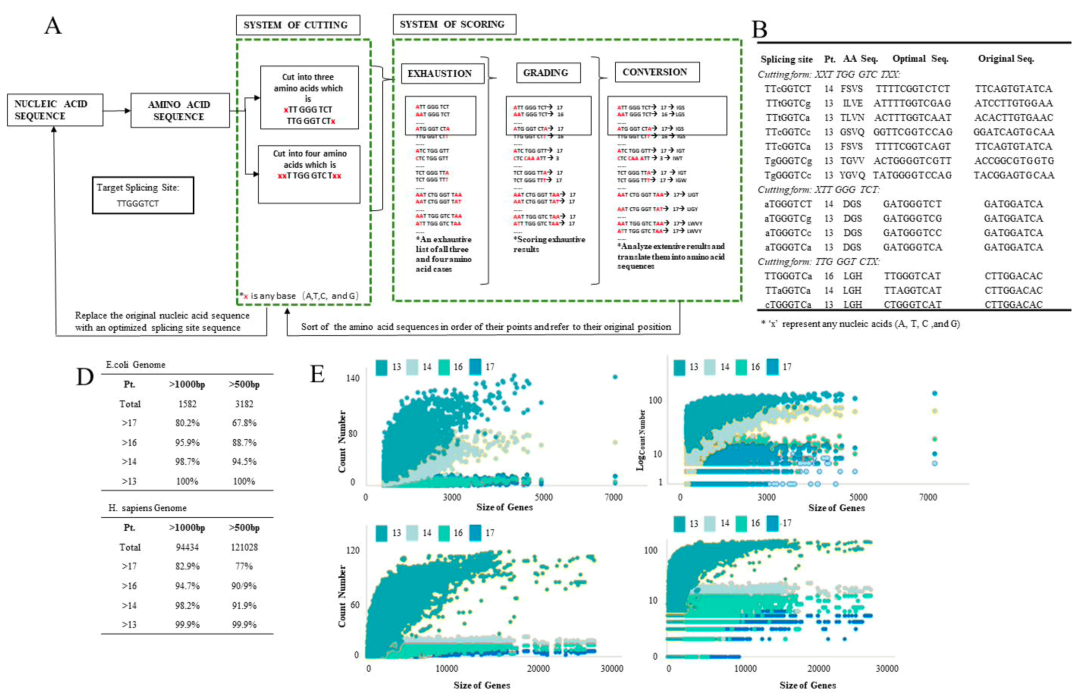
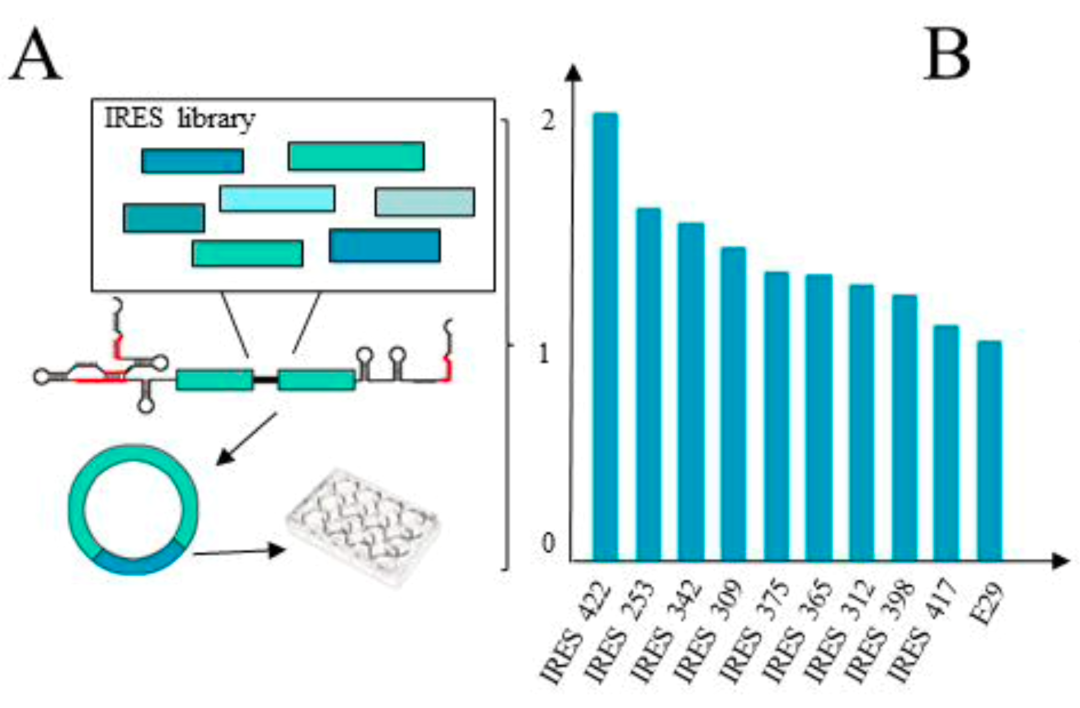
值得关注的是,新的Clean-PIE成环策略巧妙地通过筛选蛋白编码区或者IRES区找到了最优的成环位点,通过蛋白编码区或者IRES区连接成环实现了无外源序列引入,且具有环化效率高(>90%)、序列精准的特点,同时通过该方法得到的环状RNA免疫原性比ORNA所得到的环状RNA更低,且表达效率高,表达时长持久。该研究还建立了一套剪接位点自动化预测筛选系统,针对不同序列进行高效计算。另外,值得一提的是,该研究建立了高效IRES元件筛选系统,通过筛选600余条IRES序列,得到20多条新的优于CVB3表达的IRES序列。
环状RNA(circular RNA, circRNA真核生物体内是由反向剪接(back-splicing)过程产生的共价闭合环状RNA。1976年,Sanger首次在类病毒中发现了单链共价闭合环状的RNA分子,但是很长时间以来一直被认为是细胞内mRNA错误剪接的产物,并没有实际的功能。90年代末期到20世纪初,多项研究发现多种基因可以产生circRNAs。进入2010年以后,随着RNA-seq技术的发展,引爆了circRNA 研究。2017年,几个课题组相继报道了circRNAs能够在真核生物体内以帽子独立(Cap-independent)的方式翻译。
在circRNA最终走向临床应用过程中,多个关键难题摆在我们面前亟待突破:
1.如何实现circRNA高效精准环化?
2.如何避免外源序列引入带来的免疫原性?
3.如何实现circRNA高效组织特异性的表达蛋白?
4.如何获得高纯度circRNA,避免precursor和nicked RNA等杂质干扰?
5.如何实现稳定量产工艺放大?
目前体外RNA环化策略主要3种:化学方法,连接酶方法(T4 RNA ligases),核酶方法(groupⅠ、groupⅡself-splicing introns)。连接酶和核酶方法最为常用。
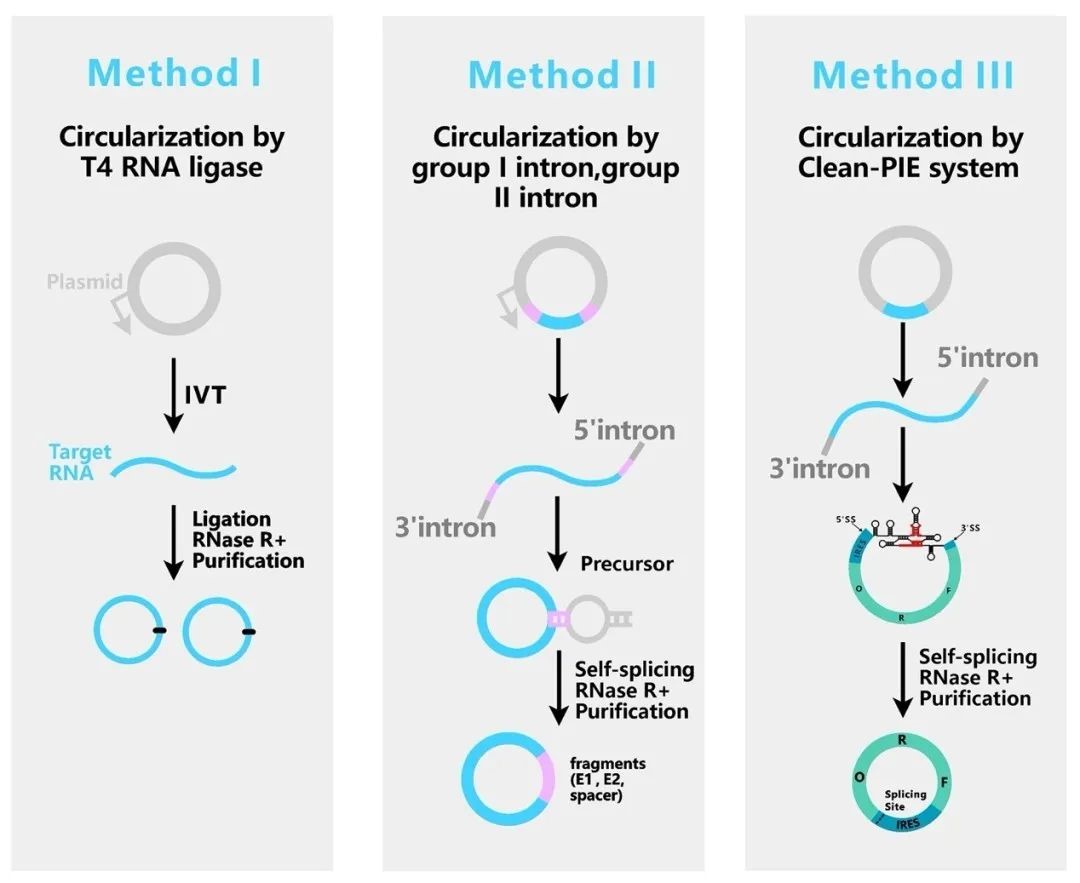
Method I:T4 RNA ligase连接
Method II:group I、group II intron 自剪接
Method III:Clean-PIE 系统,group I intron自剪接
一、I型内含子自剪接
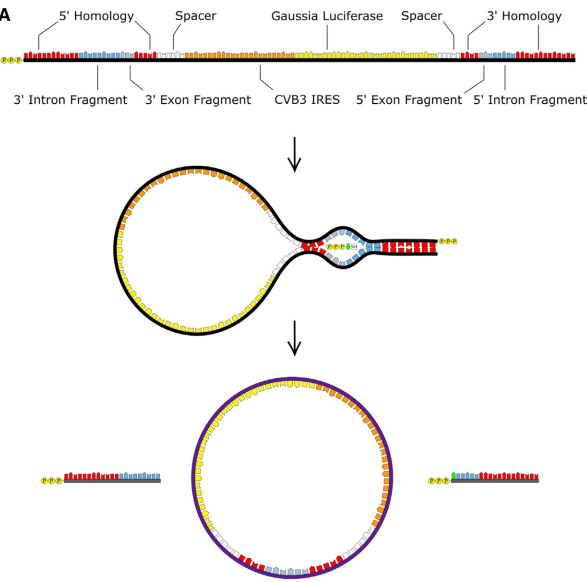
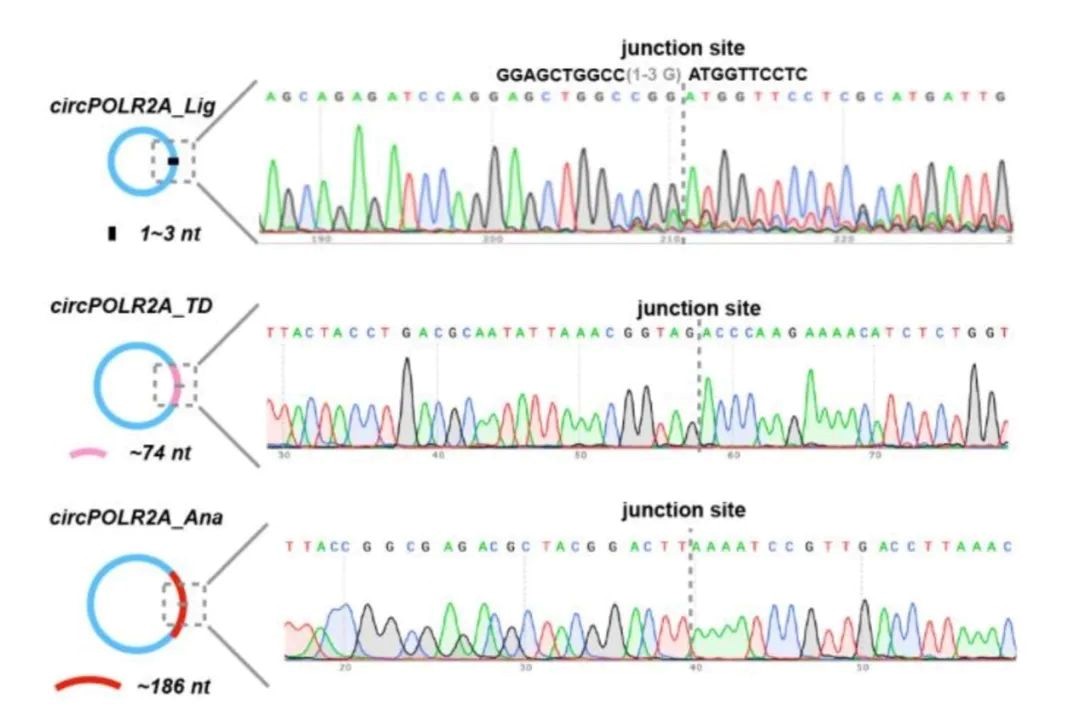
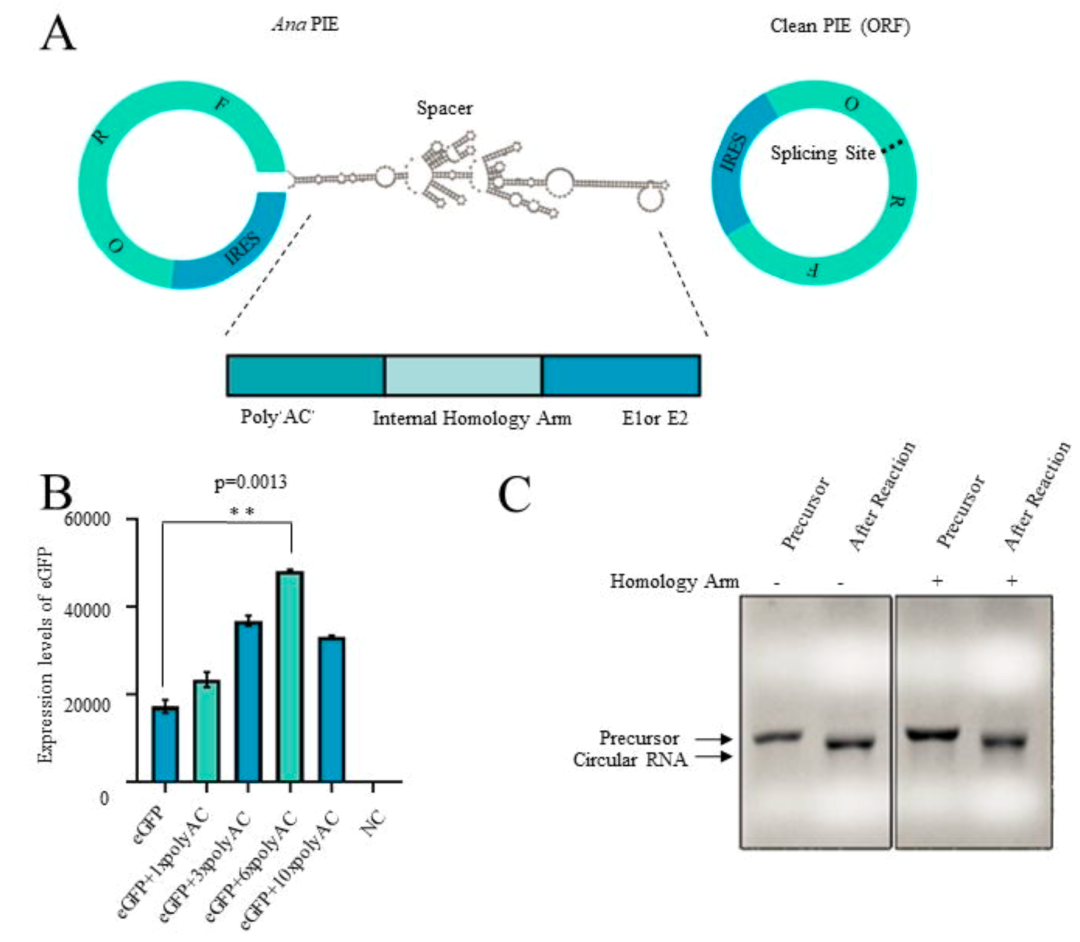
MIT Daniel. G. Anderson2研究组通过工程化改造鱼腥藻(Anabaena)I型内含子实现了体外长编码RNA的环化,在镁离子和GTP存在下,发生两次酯交换反应,形成环状RNA。通过优化经典的鱼腥藻PIE ,通过增加同源臂(homology arm)、间隔序列(spacer),解决长编码RNA序列成环的难题,并且能够得到较好的成环效率。另外一方面,通过HPLC纯化策略以及IRES序列筛选增强了circRNA在细胞内蛋白表达的稳定性和效率。这种成环策略由于增加了间隔序列且外显子序列较长,所以需要在最终的环状RNA产物中额外引入186nt碱基序列。
2022年3月,北京大学魏文胜教授使用ORNA成环框架成功制备新冠病毒RBD疫苗,并在恒河猴身上获得优秀的新冠病毒保护能力3。
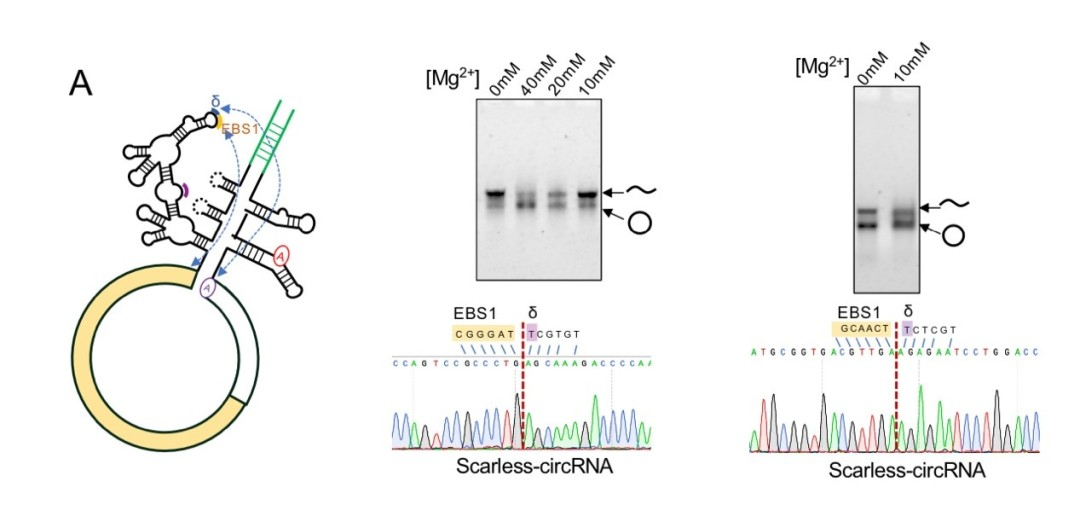
2022年初,陈玲玲教授在Molecular Cell 发表文章4指出,由Anabaena PIE或者Thymidylate synthase (TD) PIE 反向自剪接与T4连接酶方法产生的circRNA相比会引起明显高的免疫原性,并且证明了该免疫原性是由Ana PIE 或者td PIE在成环过程引入的额外序列引起的。如下图所示:
二、II型内含子自剪接
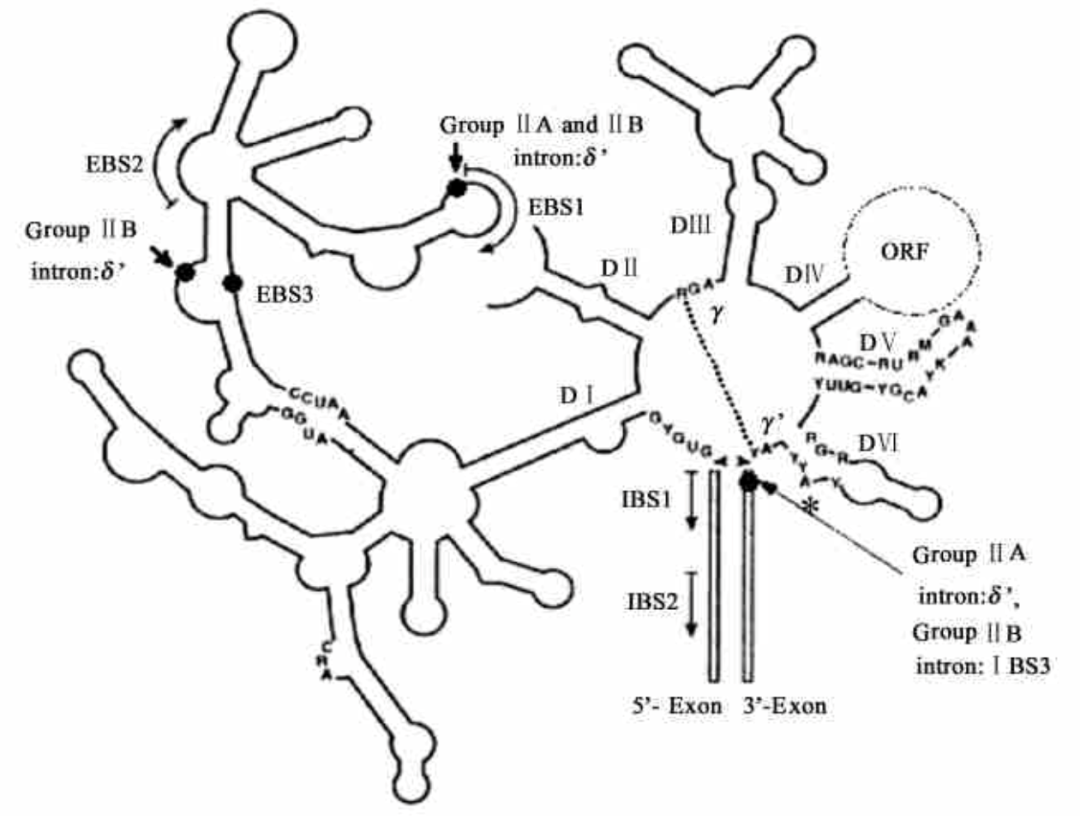
II型内含子(group II intron)存在于原生生物、真菌以及细菌基因组中。在体内II型内含子可通过两步连续的转酯反应从前体RNA中自剪接,并连接两侧外显子,许多II型内含子的剪接反应是由蛋白质辅助完成的。同时II型内含子也被证明可以在体外通过自我催化发生剪切反应。
如下图所示,采用破伤风杆菌group II intron自催化剪接反应,引入IBS1和IBS3短的外源序列,或者通过控制内含子插入过程中与外显子配对的EBS序列可改变RNA靶点,这种经过修饰的II类内含子称为“targetron”。通过这种方式设计的破伤风杆菌II型内含子和酵母菌II型内含子剪接系统可以做到无外源序列残留的circRNA人工体外制备5。如下图所示,成环效率有待提高,并且成环条带中含有的nicked RNA 需要进一步鉴定。
三、T4 RNA ligase
T4 DNA/RNA ligase 体外连接成环的方法可以避免如上外源序列引入导致的免疫原性。但是,T4连接酶相对低效的连接效率和需要借助DNA夹板序列辅助的成环方法,使其很难实现工业化制备;该方法也发展了借助内源性的夹板链实现RNA的环化3,6。如下图所示:
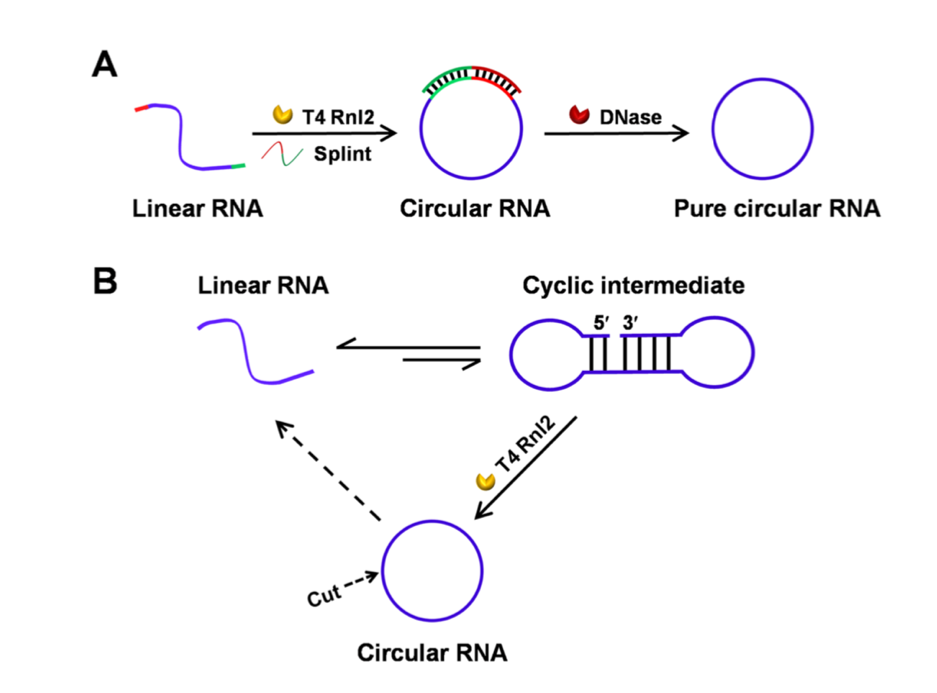
其二,T7 RNA 聚合酶在转录过程中会在3’末端随机引入1-3个额外的guanine(G)1,使得T4 RNA ligase的方法应用于IVT体外转录的RNA成环时获得的序列不准确;
其三,T4 RNA 连接酶催化单链 RNA分子间和分子内5'-磷酸基团和 3'-羟基末端形成磷酸二酯键,体外转录后需要RNA链5’末端预先去磷酸化,操作繁琐且成环效率不高。如下图所示:
四、Clean-PIE group I intron自剪接系统
ORNA group I intron Ana PIE成环策略引入186nt外源序列带来的免疫原性,破伤风杆菌和酵母菌group II intron体外较低的剪接效率,T4 RNA ligase成环方法序列不准确性和操作繁琐都是制约环状RNA应用于临床的壁垒。
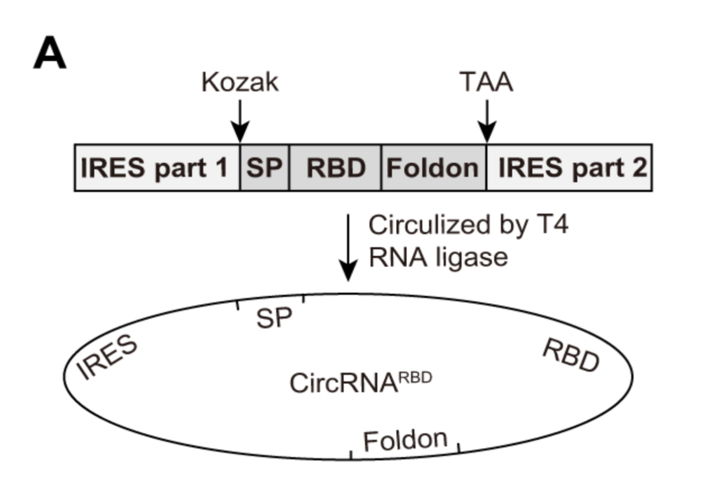
2022年6月21日,CureMed发表在预公开平台bioRvix上的文章,公开了一种新型的Clean-PIE的环状RNA成环策略。该研究巧妙地通过筛选蛋白编码区或者IRES区找到了最优的成环位点,通过蛋白编码区或者IRES区连接成环实现了无外源序列引入的RNA成环连接。
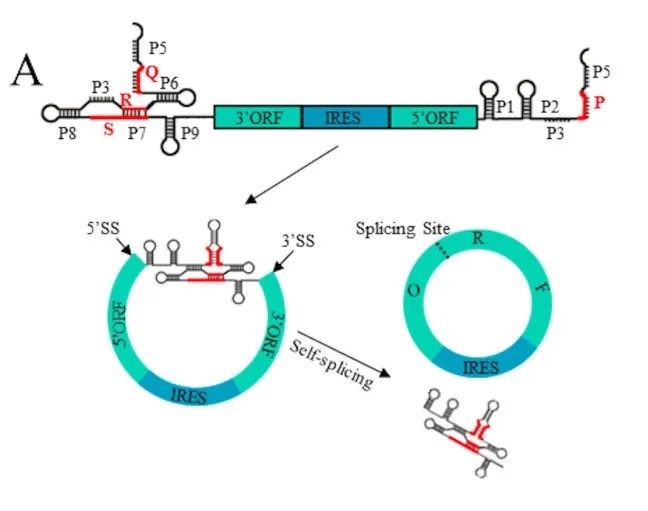
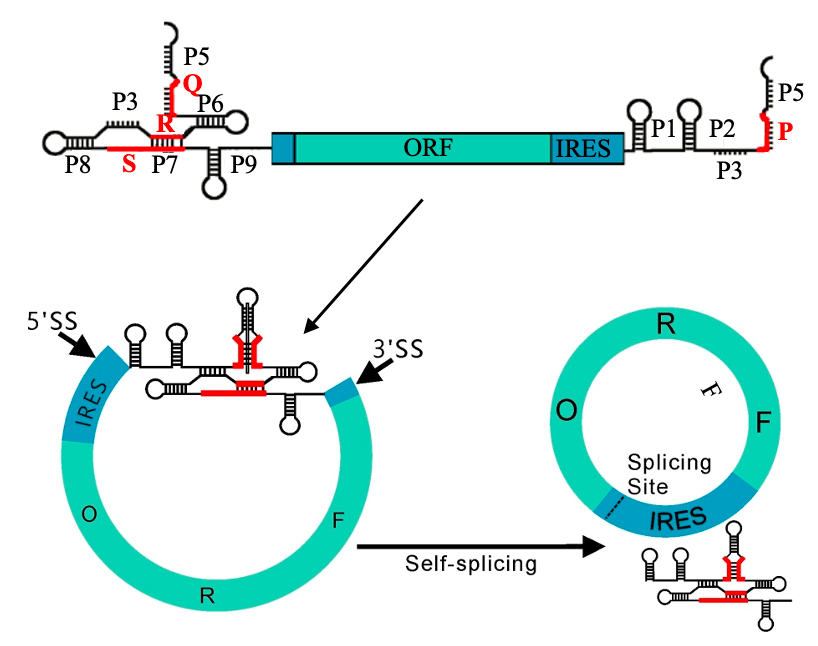
同时,该研究还建立了一套剪接位点自动化筛选优化系统。通过针对不同序列进行高效计算优选出最佳的成环位点。通过对大肠杆菌或者人类基因组内所有大于500bp的基因进行评测,发现通过优化系统可以在99.9%的H. sapiens 基因和100%的E.coli的基因中筛选的到13分以上的成环位点(即与最优成环序列只相差一个碱基)。这证明了该成环策略具有普适性。
同时该研究优化了环状RNA的序列构成,通过添加polyAC序列提高了环状RNA的表达。
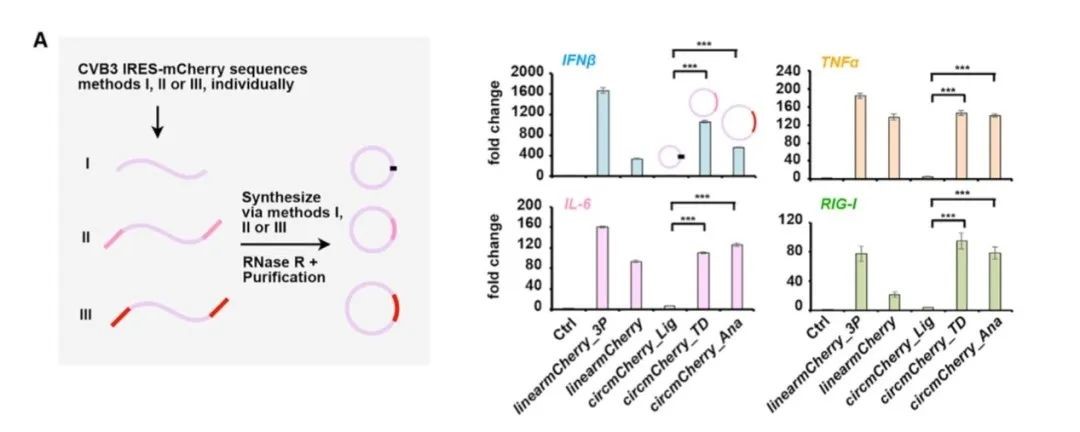
Clean-PIE系统的优点在于无外源序列引入,成环序列精准。该文章研究数据表明,相较于ORNA成环策略,转染Clean-PIE环状RNA的细胞内IFN-β、RIG-1、IL-6、MDA-5表达更低,体外细胞水平蛋白表达也明显优于ORNA。
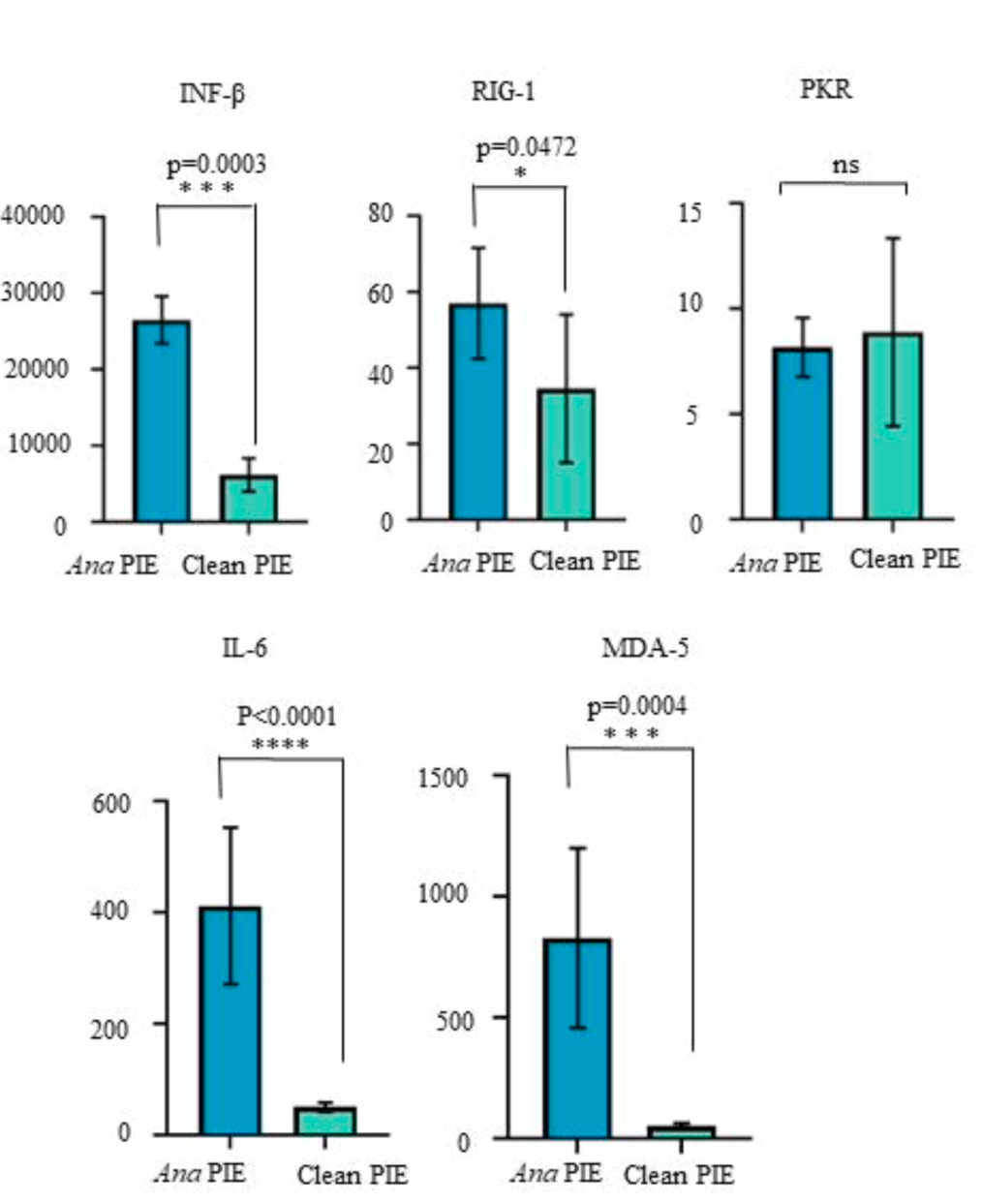
经HPLC-SEC纯化后,Ana PIE和Clean-PIE都可以实现动物体内长达20天的持续蛋白表达。体内表达的时间长度远优于线性mRNA。

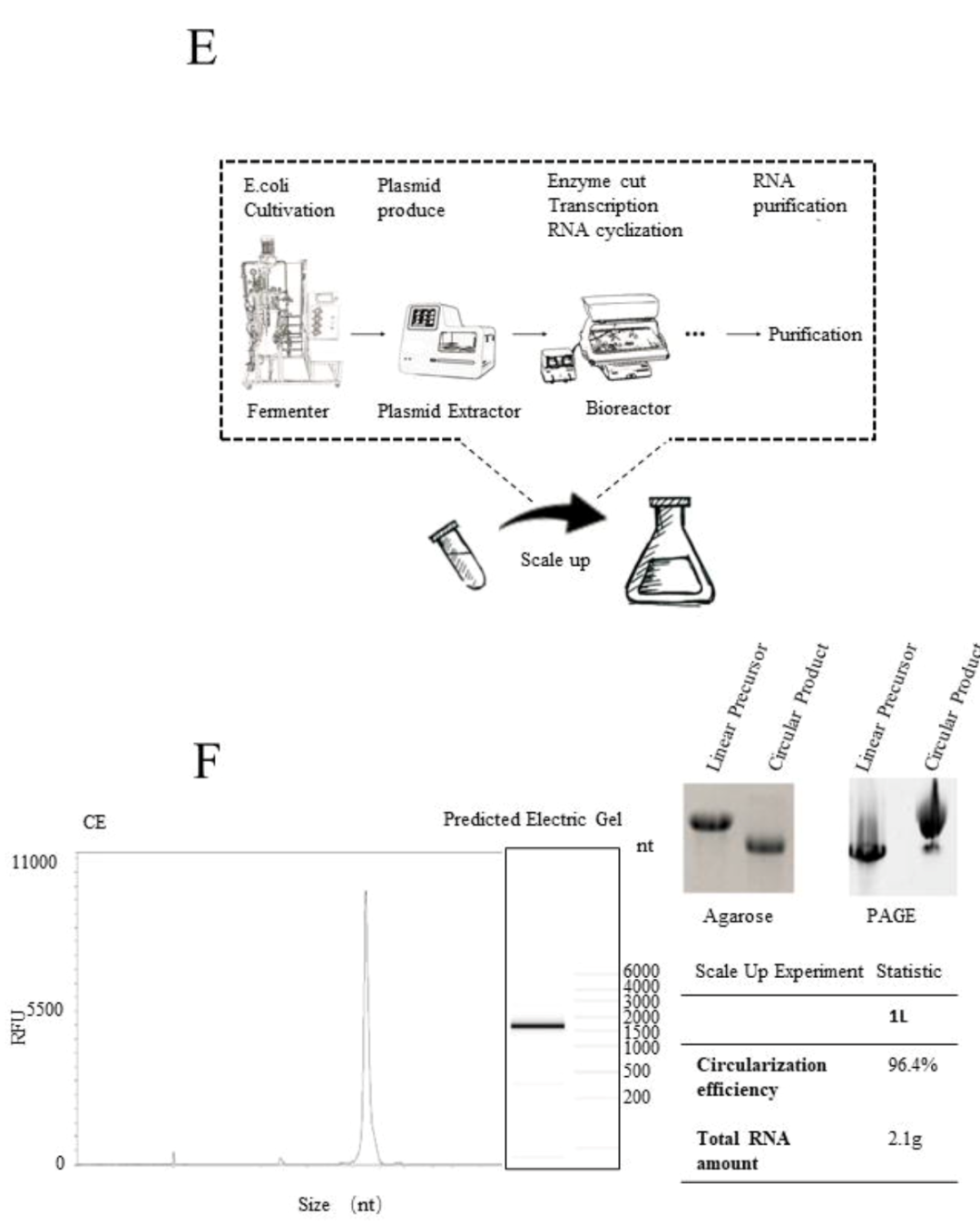
另外,该研究进一步进行了1L反应体系下的放大实验,毛细管电泳结果显示成环效率高达96.4%,琼脂糖凝胶电泳结果同样验证了高成环效率。为了进一步验证成环过程中nicked RNA的产生,评价纯化后终产品中的precursor和nicked RNA的杂质残留,通过Urea PAGE的方法检测了纯化后的环状RNA,结果表明终产品中环状RNA占比超过90%。说明Clean-PIE系统适合工业化量产,并且可以保证较高的环化效率和较纯的终产品。为进一步的临床应用奠定了基础。
另外,为了实现circRNA高效组织特异性的表达蛋白,该研究建立了高效的IRES筛选平台,已经筛选了600余个IRES序列,其中20余个IRES元件表达量显著高于CVB3,并初步掌握了IRES组织特异性表达的数据。
自2021年11月份以来,科锐迈德陆续发布了细胞因子瘤内注射7,基于环状 mRNA 的PROTAC技术8,新的LNP核酸递送技术平台9等文章,展示了LNP递送系统和环状mRNA平台技术的全面搭建成熟,并在项目应用上迅速推进。
据悉,即将推进FIRST IN CLASS的环状RNA瘤内注射项目的IIT研究,有望率先实现全球首个环状RNA FIRST IN HUMAN。
新冠疫情加速了mRNA疫苗的发展,mRNA作为平台性技术不止于疫苗,在肿瘤免疫、蛋白替代、基因治疗和细胞疗法中将会有越来越多的应用。作为mRNA2.0版本的环状mRNA技术,因其无需加帽加尾、无需核苷酸修饰、体内外更稳定、蛋白表达量更高且持久等优势,广受关注,引起了环状mRNA研究的热潮。
国际上以ORNA Therapeutics和Laronde为代表,尤其是后者获得了曾孵化Moderna公司的Flagship的4.4亿美元B轮融资,ORNA也于近期在美国基因及细胞治疗学会(ASGCT)年会上公布了其最新研究进展,继续深度布局开发IRES、LNP等底层专利技术。
国内以科锐迈德(CureMed)Clean-PIE group I intron自剪接系统、环码生物group II intron自剪接系统、圆因生物Ana PIE、吉赛生物T4 RNA ligase成环方法为代表,形成了技术方向差异鲜明的研发布局。
可以期待,在不久的未来将会有越来越多的环状mRNA研发管线来满足临床巨大的治疗需求,为患者带来治愈的希望。
[References]
1. Zonghao Qiu, Y. Z. et al. Clean-PIE: a novel strategy for efficiently constructing precise circRNA with thoroughly minimized immunogenicity to direct potent and durable protein expression..
2. Wesselhoeft, R. A., Kowalski, P. S. & Anderson, D. G. Engineering circular RNA for potent and stable translation in eukaryotic cells. Nat. Commun. 9, 2629 (2018).
3. Qu, L. et al. Circular RNA vaccines against SARS-CoV-2 and emerging variants. Cell. 185, 1728-1744 (2022).
4. Liu, C. X. et al. RNA circles with minimized immunogenicity as potent PKR inhibitors. Mol. Cell. 82, 420-434 (2022).
5. Chuyun Chen, H. W. Y. Y. A flexible, efficient, and scalable platform to produce circular RNAs as new therapeutics..
6. 梁兴国,陈辉,安然,程凯. 一种制备环状RNA的方法..
7. Jiali Yang, J. S., Jiafeng Zhu, Y. D., Yiling Tan, L. W., Qiangbo Hou, Y. Z. Z. S. & Chijian Zuo. Intratumoral Delivered Novel Circular mRNA Encoding Cytokines for Immune Modulation and Cancer Therapy..
8. Jiali Yang, J. S., Jiafeng Zhu, Y. D., Yiling Tan, L. W., Qiangbo Hou, Y. Z. Z. S. & Chijian Zuo. Circular mRNA encoded PROTAC (RiboPROTAC) as a new platform for the degradation of intracellular therapeutic targets..
9. Ke Huang, N. L. Y. L., Yuping Liu, Q. H. S. G., Ke Wei, C. D. C. Z. & Zhenhua Sun. Delivery of Circular mRNA via Degradable Lipid Nanoparticles against SARS-CoV-2 Delta Variant..
